El movimiento: lo definimos como el cambio de posicion de un cuerpo.El camino que describe un cuerpo en movimiento se denomina trayectoria y puede ser de dos tipos, la rectlinea y la curvilinea.
Para el movimiento rectilineo necesitamos un sistema de referencia que estara constituido por:
-Un eje, que indica la direccion que sigue en el cuerpo.
-Un origen, que nos dice a partir de que punto medimos la posicion que ocupa el cuerpo.
-Un sentido positivo,es decir, debemos establecer hacia que sentido de nuestro eje vamos a considerar al desplazamiento positivo.
martes, 15 de marzo de 2016
viernes, 11 de marzo de 2016
jueves, 10 de marzo de 2016
Modelo Atomico
Modelo atómico de Rutherford
Antes de la propuesta de Rutherford,los físicos aceptaban que las cargas eléctricas en el átomo tenían una distribución más o menos uniforme. Rutherford trató de ver como era la dispersión de partículas alfa por parte de los átomos de una lámina de oro muy delgada. Los ángulos deflactados por las partículas supuestamente aportarían información sobre como era la distribución de carga en los átomos. En concreto, era de esperar que si las cargas estaban distribuidas acordemente al modelo de Thomson la mayoría de las partículas atravesarían la delgada lámina sufriendo sólo ligerísimas deflacciones en su trayectoria aproximadamente recta. Aunque esto era cierto para la mayoría de partículas alfa, un número importante de estas sufrían deflexiones de cerca de 180º, es decir, prácticamente salían rebotadas en dirección opuesta a la incidente.Rutherford apreció que esta fracción de partículas rebotadas en dirección opuesta podía ser explicada si se asumía que existían fuertes concentraciones de cargas positivas en el átomo. La mecánica newtoniana en conjunción con la ley de Coulomb predice que el ángulo de deflexión de una partícula alfa relativamente ligera, por parte de un átomo de oro más pesado depende del parámetro de impacto o distancia a la que la partícula alfa pasaba del núcleo:
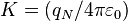 , siendo
, siendo 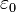 la constante dieléctrica del vacío y
la constante dieléctrica del vacío y  , es la carga eléctrica del centro dispersor.
, es la carga eléctrica del centro dispersor. , es la energía cinética inicial de la partícula alfa incidente.
, es la energía cinética inicial de la partícula alfa incidente.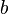 es el parámetro de impacto.
es el parámetro de impacto.
Se deduce que el parámetro de impacto debe ser bastante menor que el radio atómico. De hecho el parámetro de impacto necesario para obtener una fracción apreciable de partículas "rebotadas" sirvió para hacer una estimación del tamaño del núcleo atómico, que resulta seunas cien mil veces más pequeño que el diametro atomico.
Modelo Atomico
Modelo atómico de Sommerfeld
En 1916, Sommerfeld perfeccionó el modelo atómico de Bohr intentando paliar los dos principales defectos de éste. Para eso introdujo dos modificaciones básicas: Órbitas cuasi-elípticas para los electrones y velocidades relativistas. En el modelo de Bohr los electrones sólo giraban en órbitas circulares. La excentricidad de la órbita dio lugar a un nuevo número cuántico: el número cuántico azimutal, que determina la forma de los orbitales, se lo representa con la letra l y toma valores que van desde 0 hasta n-1. Las órbitas con:- l = 0 se denominarían posteriormente orbitales s o sharp
- l = 1 se denominarían 2 p o principal.
- l = 2 se denominarían d o diffuse.
- l = 3 se denominarían f o fundamental.
Para explicar el desdoblamiento de las líneas espectrales, observando al emplear espectroscopios de mejor calidad, Sommerfeld supone que las órbitas del electrón pueden ser circulares y elípticas. Introduce el número cuántico secundario o azimutal, en la actualidad llamado l, que tiene los valores 0, 1, 2,…(n-1), e indica el momento angular del electrón en la órbita en unidades de , determinando los subniveles de energía en cada nivel cuántico y la excentricidad de la órbita.
Modelos Atomico
Modelo atómico de John Dalton
-Explica por qué las sustancias se combinaban químicamente entre sí sólo en ciertas proporciones. Aclaraba que aún existiendo una gran variedad de sustancias diferentes,
estas podían ser explicadas en términos de una cantidad más bien
pequeña de constituyentes elementales o elementos. El modelo explicaba la mayor parte de la química orgánica del siglo
XIX, reduciendo una serie de hechos complejos a una teoría combinatoria
realmente simple.
Modelo atómico de Thomson
-El átomo está compuesto por electrones de carga negativa en un átomo positivo, como pasas en un budín. Dado que el átomo no deja de ser un sistema material que contiene una cierta cantidad de energía externa, ésta provoca un cierto grado de atracción de los electrones contenidos en la estructura atómica. Desde este punto de vista, puede interpretarse que el modelo atómico de Thomson es un modelo actual como consecuencia de la elasticidad de los electrones en el coseno de la citada estructura.
Modelo atómico de Bohr
Es un modelo cuantizado del átomo propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo. Este modelo planetario es un modelo funcional que no representa el átomo (objeto físico) en sí ,sino que explica su funcionamiento por medio de ecuaciones.
Modelo atómico de Schrödinger
-Se basa en la solución de la ecuación de Schrödinger para un potencial electrostático con simetría esférica, llamado también átomo hidrogenoide. En este modelo el electrón se contemplaba originalmente como una onda estacionaria de materia cuya amplitud decaía rápidamente al sobrepasar el radio atómico.
viernes, 4 de marzo de 2016
Reacciones quimicos
Es un proceso en el que una o mas sustancias reacionan para dar otras propiedades diferentes (productos).
Las reacciones quimicas se representan por medio de ecuaciones quimicos: en el primer miembro se escriben las formulas de los reactivos, y en el segundo, las de los productos.
Energia de activacion: Para que se posible una reaccion quimica, las particulas deben chocar con una energia minima o energia de activacion. Una vez que los enlaces de los reactivos se han roto, se forman otros enlaces nuevos que dan lugar a los productos.
Energia de reaccion: El intercambio de energia que se produce en el transcurso de una reaccion qumica se denomina energia de activacion, y es la diferencia entre el contenido energetico de los productos y el de los reactivos. Ereaccion=Eproductos-Ereactivos
Velocidad de reaccion: Es la velocidad a la que transcurre una reaccion quimica, o dicho de otra forma, es la variacion en el tiempo de la concentracion de una de las sustancias, reactivos o productos. Las reacciones pueden ser rapidas o lentas.
Factores que influyen en la velocidad de reaccion: Naturaleza de los reactivos,Temperatura, Grado de division de los reactivos, Concentracion, Catalizadores.
Las reacciones quimicas se representan por medio de ecuaciones quimicos: en el primer miembro se escriben las formulas de los reactivos, y en el segundo, las de los productos.
Energia de activacion: Para que se posible una reaccion quimica, las particulas deben chocar con una energia minima o energia de activacion. Una vez que los enlaces de los reactivos se han roto, se forman otros enlaces nuevos que dan lugar a los productos.
Energia de reaccion: El intercambio de energia que se produce en el transcurso de una reaccion qumica se denomina energia de activacion, y es la diferencia entre el contenido energetico de los productos y el de los reactivos. Ereaccion=Eproductos-Ereactivos
Velocidad de reaccion: Es la velocidad a la que transcurre una reaccion quimica, o dicho de otra forma, es la variacion en el tiempo de la concentracion de una de las sustancias, reactivos o productos. Las reacciones pueden ser rapidas o lentas.
Factores que influyen en la velocidad de reaccion: Naturaleza de los reactivos,Temperatura, Grado de division de los reactivos, Concentracion, Catalizadores.
jueves, 3 de marzo de 2016
Enlace quimico
Los atomos se unen mediante los electrones mas externos de la corteza atomica para alcanzar una situacion de mayor estabilidad, como la de los gases nobles, cuya ultima capa esta completa (con 8 electrones).
Segun como se produzca la union entre los atomos, existen tres tipos de enlaces: Ionico,covalente y metalico.
Segun como se produzca la union entre los atomos, existen tres tipos de enlaces: Ionico,covalente y metalico.
miércoles, 2 de marzo de 2016
Isotopos
Si un atomo gana o pierde neutrones, no cambia Z pero si lo hace A. Cuando tenemos atomos con igual numero atomico pero distinto numero masico, los denominamos isotopos.
El atomo
Ruthford consideraba que el atomo estaba dividido en dos partes muy diferenciadas: nucleo y corteza.
Nucleo- se encuentran los protones y los neutrones que constituyen la mayor parte de la masa de todo el atomo. Los protones poseen carga positiva y neutrones no tienen carga.
Corteza- se encuentran los electrones orbitando alrededor del nucleo. Los electrones tienen una masa 1000 veces mas pequeña que la de los protones y neutrones. Poseen carga electrica igual a la de proton pero negativa.
Nucleo- se encuentran los protones y los neutrones que constituyen la mayor parte de la masa de todo el atomo. Los protones poseen carga positiva y neutrones no tienen carga.
Corteza- se encuentran los electrones orbitando alrededor del nucleo. Los electrones tienen una masa 1000 veces mas pequeña que la de los protones y neutrones. Poseen carga electrica igual a la de proton pero negativa.
Suscribirse a:
Entradas (Atom)

 Ionico
Ionico covalente
covalente metalico
metalico
